Atomu
Un atomu (da u grecu anticu ἄτομος) hè a più piccula parte di un corpu simplice pudendu cumbinà si chimicamente incù un antru.[1] L'atomi sò i custituenti elementari di tutte e sustanze solide, liquide o gasose.
Ogni atomu hè cumpostu da un nucleu è da unu o parechji elettroni ligati à u nucleu. U nucleu hè custituitu da unu o parechji prutoni è da uni belli pochi di neutroni. Sola a varietà a più currente d'idrogenu ùn pussede micca neutroni.
Ogni solidu, liquidu, gasu è plasma hè cumpostu d'atomi neutri o iunizati. L'atomi sò estremamente chjuchi, di solitu di circa 100 picometri di diamitru. Sò cusì chjuchi ch'ellu hè impussibile di predisce ne incù accuratezza u cumpurtamentu imprudendu a fisica classica, cum'è s'ellu si trattava di palline di tennis per indettu, per causa di effetti quantichi.
Più di 99,94% di a massa di un atomu si trova in u nucleu. I prutoni anu una carica elettrica pusitiva, l'elettroni anu una carica elettrica negativa è i neutroni ùn anu micca carica elettrica. S'è u numeru di prutoni è d'elettroni hè uguale, l'atomu hè elettricamente neutru. S'è un atomu pussede più o menu d'elettroni ch'è di prutoni, hà tandu una carica glubale negativa o pusitiva, rispittivamente - 'ssi atomi sò chjamati ioni.
L'elettroni di un atomu sò attratti da i prutoni di u nucleu atomicu da a forza elettrumagnetica. I prutoni è i neutroni di u nucleu sò attratti l'uni da l'altri da a forza nucleare. 'Ssa forza hè di solitu più forte ch'è a forza elettrumagnetica chì rispinghje i prutoni carchi pusitivamente l'uni da l'altri. In certe circustanze, a forza elettrumagnetica ripulsiva diventa più forte ch'è a forza nucleare. In 'ssu casu, u nucleu si divide è lascia daretu à ellu varii elementi. Si tratta di una forma di disgregazione nucleare.
U numeru di prutoni in u nucleu hè u numeru atomicu è definisce l'elementu chimicu à u quale l'atomu appartene. Per indettu, ogni atomu chì cuntene 29 prutoni hè ramu. U numeru di neutroni definisce l'isotupu di l'elementu. Per indettu, un atomu di ramu incù 34 neutroni hè u ramu-63, è incù 36 neutroni hè u ramu-65. U ramu naturale hè cumpostu di à l'incirca 70% di Cu-63 è u restu di Cu-65.
L'atomi ponu ligà si à unu o parechji altri atomi da leghe chimiche per furmà cumposti chimichi tali molecule o cristalli. Per indettu, a Statua di a Libertà di New York era à l'origine fatta di ramu puru, ma in u corsu di l'anni, a superficia si hè cumbinata à atomi d'ossigenu, di carboniu è di zolfaru per furmà una patina verde annantu à u ramu. A capacità di l'atomi à ligà si è à staccà si hè rispunsevule di a maiò parte di i cambiamenti fisichi ossirvati in a natura. A chimica hè a disciplina chì studieghja 'ssi cambiamenti.
Storia di a teuria atomica
[mudificà | edità a fonte]In filusufia
[mudificà | edità a fonte]L'idea di basa sient'è a quale a materia hè custituita da minuscule particule indivisibile hè un'idea anziana chì hè apparsa in numerose culture anziane cum'è quelle di a Grecia è di l'India. A parola atomu hè derivata da u parola grecu anticu atomos, chì significheghja "indivisibile".'Ss'idea anziana era basata annantu à un raghjunamentu filusoficu nanzu ch'è annantu à un raghjunamentu scentificu. A teuria atomica muderna ùn hè micca fundata annantu à 'ssi anziani cuncetti.
À u principiu di u XIXu seculu, u scentificu John Dalton hà rimarcatu ch'è l'elementi chimichi parianu cumbinà si trà di elli da unità di pesu di basa, è hà dicisu d'usà a parola atomu per designà 'ss'unità chì supponia ch'ellu si trattava di l'unità fundamentale di a materia. À l'incirca un seculu dopu, omu hà scupertu ch'è l'atomi di Dalton ùn eranu micca rialmente indivisibili, ma u termine hè firmatu.
Teuria cinetica di i gasi
[mudificà | edità a fonte]In u 1738, Daniel Bernoulli è uni belli pochi d'altri scentifichi anu scupertu ch'elli pudianu spiigà megliu u cumpurtamentu di i gasi discrivendu li cum'è racolte di particule submicroscopiche è mudellizendu u so cumpurtamentu cù l'aiutu di statistiche è di prubabilità. In cuntrariu di a teuria atomica di Dalton, a teuria cinetica di i gasi ùn discrive micca cumu i gasi riagiscenu chimicamente trà di elli per furmà cumposti, ma cume elli si cumportanu fisicamente : diffusione, viscusità, cunduttività, prissione, è cetera.
U muvimentu brownianu
[mudificà | edità a fonte]In u 1827, u botanistu Robert Brown hà usatu un microscopiu per ossirvà granelli di polvera gallighjendu in acqua è hà scupertu ch'elli si cullucavanu di manera erratica, un finominu cunnisciutu sottu u nome di "muvimentu brownianu". Omu pinsava ch'è 'ssu finominu era duvutu à e molecule d'acqua chì facianu move i granelli. In u 1905, Albert Einstein hà pruvatu a rialità di 'sse molecule è di i so muvimenti pruducendu a prima analisi di fisica di u muvimentu brownianu. U fisicu francese Jean Perrin hà usatu i travagli di Einstein per diterminà in modu sperimentale a massa è e dimensione di e molecule, arrichendu cusì a prova fisica di a natura di particula di a materia.
Scuperta di l'elettrone
[mudificà | edità a fonte]In u 1897, J. J. Thomson scopre ch'è i raghji catodichi ùn sò micca onde elettrumagnetiche ma sò custituiti da particule 1800 volte più lebbie ch'è l'idrogenu (l'atomu u più lebbiu). Thomson hà cunchjusu ch'è 'sse particule pruvenianu di l'atomi indrentu à u catodu - si trattava di particule subatomiche. Hà chjamatu 'sse nuvelle particule corpusculi, ma anu dopu state ribattizate elettroni. Thomson hà ancu mustratu ch'è l'elettroni eranu identichi à e particule emesse da i materiali fotoelettrichi è radiuattivi. Fubbe prestu ricunnusciutu ch'è l'elettroni sò e particule chì trasportanu i currenti elettrichi in i fili metallichi. Thomson hà cunchjusu ch'è 'ssi elettroni emergianu di l'atomi stessi di u catodu di i so strumenti, ciò chì significheghja ch'è l'atomi ùn sò micca indivisibili cum'è lu pinsava Dalton.
Scuperta di u nucleu
[mudificà | edità a fonte]J. J. Thomson pinsava ch'è l'elettroni carchi negativamente eranu scumpartuti in l'inseme di l'atomu in un mare di carica pusitiva chì era distribuita in tuttu u vulume di l'atomu. 'Ssu mudellu hè qualchì volta cunnisciutu sottu u nome di mudellu di u plum-pudding. Ernest Rutherford è i so culleghi Hans Geiger è Ernest Marsden anu cuminciatu à avè dubbiti annantu à u mudellu di Thomson dopu à avè scuntratu difficultà quand'elli anu pruvatu à custruisce un strumentu per misurà u rapportu carica-massa di e particule alpha (particule carche pusitivamente emesse da certe sustanze radiuattive cum'è u radiu). E particule alpha eranu spergugliate da l'aria di a camera di rilevamentu, ciò chì rendia e misure pocu affidevule. Thomson avia scuntratu un prublema simile in i so travagli annantu à i raghji catodichi, ch'ellu avia risoltu criendu un biotu guasi perfettu in i so strumenti. Rutherford ùn pinsava micca scuntrà listessu prublema chì e particule alpha sò assai più greve ch'è l'elettroni. Sient'è u mudellu di l'atomu di Thomson, a carica pusitiva di l'atomu ùn hè micca abbastanza cuncintrata per produce un campu elettricu abbastanza forte per svià una particula alpha, è l'elettroni sò cusì lebbii ch'elli duverianu esse scartati senza sforzu da e particule alpha assai più greve. Eppuru, ci hè statu diffusione, è Rutherford è i so culleghi anu dicisu di studià 'ssa diffusione incù cura. Trà u 1908 è u 1913, Rutherford è i so culleghi anu rializatu una seria di sperimenti à u corsu di e quale anu bumbardatu fine foglie di metallu incù particule alpha. Anu custattatu ch'è e particule alpha eranu sviate da anguli superiori à 90. Per spiigà 'ssu finominu, Rutherford prupone ch'è a carica pusitiva di l'atomu ùn sia micca scumpartuta in tuttu u vulume di l'atomu, cum'è a pinsava Thomson, ma ch'è ella sia cuncintrata in un minusculu nucleu à u centru. Sola una cuncintramentu di carica tantu intensu pudia produce un campu elettricu abbastanza putente per svià e particule alpha cum'è omu l'hà ossirvatu.
Scuperta di l'isotupi
[mudificà | edità a fonte]In u 1913, mentre spirimintava i produtti di a disgregazione radiuattiva, u radiochimicu Frederick Soddy hà scupertu chì ci paria esse più di un tipu d'atomu à ogni pusizione di u tavulellu periodicu. U termine isotupu hè stata invintatu da Margaret Todd per designà i sfarenti atomi appartinendu à listessu elementu. J. J. Thomson hà criatu una tecnica di siparazione di l'isotupi grazia à i so travagli annantu à i gasi iunizati, ciò chì hà cunduttu dopu à a scuperta di l'isotupi stabili.
Mudellu di Bohr
[mudificà | edità a fonte]
U mudellu di Bohr di l'atomu, incù un elettrone fendu salti quantichi subitanii da una orbita à l'altra incù guadagnu o perdita d'energia. 'Ssu mudellu d'elettroni in orbite hè obsoletu. In 1913, u fisicu Niels Bohr hà prupostu un mudellu in qualessu l'elettroni di un atomu eranu supposti gravità intornu à u nucleu ma ùn a pudianu fà ch'è annantu à un inseme finitu d'orbite, è ùn pudianu saltà trà 'sse orbite ch'è à u mumentu di cambiamenti discreti d'energia currispondendu à l'assurbimentu o à u irraghjamentu di un fotone. 'Ssa quantificazione hè stata imprudata per spiigà perchè l'orbite di l'elettroni sò stabile (datu chì nurmalmente, e cariche in accilerazione, cumpresu in muvimentu circulare, perdenu l'energia cinetica chì hè emessa sottu forma di irraghjamentu elettrumagneticu) è perchè l'elementi assurbiscenu è emettenu un irraghjamentu elettrumagneticu in spettri discreti. Dopu in listessu annu, Henry Moseley hà furnitu prove sperimentale supplementarie à favore di a teuria di Niels Bohr. 'Ssi risultati anu affinatu u mudellu d'Ernest Rutherford è di Antonius van den Broek, chì prupunia ch'è l'atomu cuntena in u so nucleu un numeru di cariche nucleare pusitive uguale à u so numeru atomicu in u tavulellu periodicu. Sinu à 'ssi sperimenti, u numeru atomicu ùn era micca cunnisciutu, essendu una quantità fisica è sperimentale. U fattu ch'ellu sia uguale à a carica nucleare di l'atomu ferma oghje u mudellu atomicu accittatu. E leghe chimiche trà l'atomi sò state spiigate da Gilbert Newton Lewis in 1916, essendu l'interazzione trà i so elettroni custitutivi. E pruprietà chimiche di l'elementi essendu cunnisciute per ripete si largamente sient'è a leghje periodica, u chimicu americanu Irving Langmuir hà sugiritu in u 1919 ch'è quessa pudia spiigà si s'è l'elettroni di un atomu eranu cunnessi o ragruppati di una certa manera. Omu pinsava ch'è i gruppi d'elettroni accupavanu un inseme di cunchiglie elettroniche intornu à u nucleu. U mudellu di Bohr di l'atomu hè statu u prima mudellu fisicu cumplettu di l'atomu. Discrivia a struttura glubale di l'atomu, u modu chì l'atomi si leganu trà di elli è prediscia e linie spettrale di l'idrogenu. U mudellu di Bohr ùn era micca perfettu è hè prestu statu rimpiazzatu da u mudellu di Schrödinger, più pricisu, ma hè bastatu à fà sparisce l'ultimi dubbiti annantu à u fattu ch'è a materia hè cumposta d'atomi. Per i chimichi, l'idea di l'atomu era stata un arnese euristicu utule, ma i fisichi dubbitavanu ch'è a materia sia rialmente cumposta d'atomi, chì nimu ùn avia dinù sviluppatu un mudellu fisicu cumplettu di l'atomu.
Mudellu di Schrödinger
[mudificà | edità a fonte]U sperimentu di Stern-Gerlach, rializatu in u 1922, hà arricatu nove prove di a natura quantica di e pruprietà atomiche. Quandu un fasciu d'atomi d'argentu attraversa un campu magneticu di forma spiciale, u fasciu hè divisu sicondu a direzzione di u mumentu angulare di l'atomu, o spin. Cum'è 'ssa direzzione di u spin hè à l'iniziu aleatoria, omu aspitteria ch'è u fasciu sviessi in una direzzione aleatoria. À u locu di quessa, u fasciu hè divisu in duie compunenti direzziunale, currispondendu à l'orientamentu di u spin atomicu à l'insù o à l'inghjò riguardu à u campu magneticu. In 1925, Werner Heisenberg hà publicatu a prima formulazione matematica cuerente di a meccanica quantica (meccanica matriziale). Un annu più prestu, Louis di Broglie avia prupostu l'ipotesi di Broglie : tutte e particule si cumportanu in una certa misura cum'è di l'onde. In u 1926, Erwin Schrödinger si hè servutu di 'ss'idea per sviluppà l'equazione di Schrödinger, un mudellu matematicu di l'atomu (meccanica ondulatoria) chì discrive l'elettroni cum'è forme d'onda tridimensiunale innanzu ch'è cum'è particule puntuale. L'usu di forme d'onda per discrive e particule hà per cunsequenza ch'ellu hè matematicamente impussibile d'ottene valori pricise à tempu per a pusizione è a quantità di muvimentu di una particula à un mumentu datu. Hè ciò ch'è omu chjama u principu d'incertezza, furmulatu da Werner Heisenberg in 1927. Sient'è 'ssu cuncettu, per un'accuratezza data in a misura di una pusizione, omu ùn pò ottene ch'è una gamma di valori prubabili per a quantità di muvimentu, è viciversu. 'Ssu mudellu hà permessu di spiigà ossirvazione di u cumpurtamentu atomicu ch'è i mudelli precedenti ùn pudianu spiigà, cum'è certi mudelli strutturali è spettrali d'atomi più grandi ch'è l'idrogenu. Cusì, u mudellu planitariu di l'atomu hè statu scartatu à favore di un mudellu chì discrivia e zone orbitale atomiche intornu à u nucleu induve un elettrone datu hà u più scianze d'esse ossirvatu.
Scuperta di u neutrone
[mudificà | edità a fonte]U sviluppu di u spettrometru di massa hà permessu di misurà a massa di l'atomi incù un'accuratezza accrescuta. L'apparechju usa un calamita per svià a tragettoria di un fasciu d'ioni, è a quantità di diviazione hè diterminata da u rapportu trà a massa di l'atomu è a so carica. U chimicu Francis William Aston hà imprudatu stu strumentu per mustrà ch'è l'isotupi avianu masse differente. A massa atomica di 'ssi isotupi variava sicondu quantità intiere, ciò ch'è omu chjama a regula di i numeri intieri. A spiigazione di 'ssi sfarenti isotupi hà aspittatu a scuperta di u neutrone, una particula non carca chì a so massa hè simile à quella di u prutone, da u fisicu James Chadwick in 1932. L'isotupi eranu tandu spiigati cum'è elementi avendu listessu numeru di prutoni, ma un numeru sfarente di neutroni in u nucleu.
Fissione, fisica di l'alte energie è materia cundinsata
[mudificà | edità a fonte]In u 1938, u chimicu alemanu Otto Hahn, elevu di Rutherford, hà direttu neutroni annantu à atomi d'uraniu aspittendu si à ottene elementi trasuraniani. À u locu di quessa, i so isperimenti chimichi anu mustratu ch'è u bariu era un produttu. Un annu dopu, Lise Meitner è u so nipote Otto Frisch anu virificatu ch'è u risultatu di Hahn era a prima fissione nucleare sperimentale. In u 1944, Hahn hà ricevutu u premiu Nobel di chimica. Malgradu i sforzi di Hahn, i cuntributi di Meitner è di Frisch ùn fubbenu micca ricunnusciuti. In l'anni 1950, u sviluppu d'acceleratori è di ditettori di particule migliurati hà permessu à i scentifichi di studià l'impatti di l'atomi culluchendu si à alta energia. Omu hà scupertu ch'è i neutroni è i prutoni eranu adroni, o icumpositi di particule più chjuche chjamate quark. Omu hà elaburatu u mudellu standard di a fisica di e particule chì, sin'à avà, hè riesciutu à spiigà e pruprietà di u nucleu in termini di 'sse particule subatomiche è di e forze chì regenu e so interazzione.
Struttura
[mudificà | edità a fonte]Nucleu
[mudificà | edità a fonte]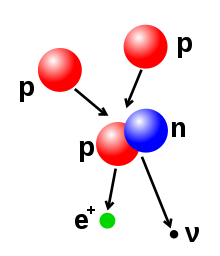
Tutti i prutoni è neutroni ligati in un atomu custituiscenu un minusculu nucleu atomicu è sò chjamati cullittivamente nucleoni. U raghju di un nucleu hè apprussimativamente uguale à 1,07 femtometri, induve A hè u numeru tutale di nucleoni. 'Ssu ciffru hè beddu più chjucu ch'è u raghju di l'atomu, chì hè di circa 105 fm. I nucleoni sò ligati trà di elli da un putenziale d'attrazzione à corta distanza chjamatu forza forte residua. À distanze inferiore à 2,5 fm, 'ssa forza hè assai più putente ch'è a forza elettrostatica chì face ch'è i prutoni carchi pusitivamente si rispinghjenu. L'atomi di un stessu elementu anu listessu numeru di prutoni, chjamatu numeru atomicu. In senu à un stessu elementu, u numeru di neutroni pò varià, ciò chì ditermineghja l'isotupu di stu elementu. U numeru tutale di prutoni è di neutroni ditermineghja u nuclidu. U numeru di neutroni riguardu à e prutoni ditermineghja a stabilità di u nucleu, certi isotupi subiscendu una disgregazione radiuattiva.
U prutone, l'elettrone è u neutrone sò classificati frà i fermioni. I fermioni ubbidiscenu à u principu d'esclusione di Pauli chì interdisce à fermioni identichi, cum'è parechji prutoni, d'occupà listessu statu quanticu à listessu mumentu. Cusì, ogni prutone di u nucleu deve occupà un statu quanticu sfarente di tutti l'altri prutoni, ed hè listessa per tutti i neutroni di u nucleu è tutti l'elettroni di u nivulu elettronicu.
Un nucleu chì u so numeru di prutoni hè sfarente di quellu di i neutroni pò putenzialmente passà à un statu di minima energia per via di una disgregazione radiuattiva chì face currisponde più strettamente u numeru di prutoni è di neutroni. Per via di cunsequenza, l'atomi chì i so numeri di prutoni è di neutroni currispondenu sò più stabili contru à a disgregazione, ma incù l'aumentu di u numeru atomicu, a ripulsione mutua di i prutoni necessiteghja una prupurzione criscente di neutroni per mantene a stabilità di u nucleu.
U numeru di prutoni è di neutroni in u nucleu atomicu pò esse mudificatu, benchì quessa necessiteghja energie assai alte per causa di a forza forte. A funditura nucleare si produce quandu parechje particule atomiche si uniscenu per furmà un nucleu più grevu, per indettu da l'inticciu energeticu di dui nuclei. Per indettu, à u core di u Sole, i prutoni anu bisognu di un'energia di 3 à 10 keV per superà a so ripulsione mutua - u cateru di coulomb - è adunisce si in un solu nucleu. A fissione nucleare hè u prucessu inversu : un nucleu si divide in dui nuclei più chjuchi, di solitu per via di disgregazione radiuattiva. U nucleu pò ancu esse mudificatu per via di bumbardamentu da particule subatomiche o da fotoni di alta energia. S'è quessa mudificheghja u numeru di prutoni in un nucleu, l'atomu si trasforma in un elementu chimicu sfarente.
S'è a massa di u nucleu in seguitu à una riazzione di funditura hè inferiore à a somma di e masse di e particule siparate, a differenza trà 'sse duie valori pò esse emessa sottu à a forma di un tipu d'energia usevule (cum'è un raghju gamma, o l'energia cinetica di una particula beta), cum'ella u discrive a formula d'equivalenza massa-energia d'Albert Einstein, E = mc 2, induve m hè a perdita di massa è c a velucità di a luce. 'Ssu mancu face parte di l'energia di lega di u nuvellu nucleu, è hè a perdita non ricuperevule di 'ss'energia chì face ch'è e particule adunite fermanu inseme in un statu chì necessiteghja 'ss'energia per spiccà si.
A funditura di dui nuclei chì creanu nuclei più grossi è di numeri atomichi inferiori à quelli di u ferru è di u nichellu - un numeru tutale di nucleoni di circa 60 - hè di solitu un prucessu esotermicu chì libereghja più energia ch'ellu ne ci vole per riunisce li. Hè 'ssu prucessu di liberazione d'energia chì face di a funditura nucleare in e stelle una riazzione chì s'intratene da per ella. Per i nuclei più grevi, l'energia di lega da nucleone in u nucleu principia à diminuisce. Quessa significheghja ch'è i prucessi di funditura pruducendu nuclei chì u so numeru atomicu hè superiore à circa 26 è a massa atomica superiore à à circa 60 sò prucessi endotermichi. 'Ssi nuclei più massicci ùn ponu micca subisce una riazzione di funditura produttrice d'energia suscettibile di mantene l'equilibriu idrostaticu di una stella.
Nivulu d'elettroni
[mudificà | edità a fonte]
L'elettroni di un atomu sò attratti da i prutoni di u nucleu da a forza elettrumagnetica. 'Ssa forza lega l'elettroni à l'internu di un pozzu di putenziale elettrostaticu circundendu u picculu nucleu, ciò chì significheghja ch'è una surghjente d'energia esterna hè necessaria affinch'è l'elettrone scappessi. Più un elettrone hè prossimu da u nucleu, più a forza d'attrazzione hè grande. Per via di cunsequenza, l'elettroni ligati vicinu à centru di u pozzu di putenziale anu bisognu di più d'energia per scappà ch'è quelli chì sò più alluntanati.
L'elettroni, cum'è l'altre particule, anu e pruprietà di una particula è di un'onda. U nivulu d'elettroni hè una rigione à l'internu di u pozzu di putenziale induve ogni elettrone forma una sorta d'onda staziunaria tridimensiunale - una forma d'onda chì ùn si dispiazza micca riguardu à u nucleu. 'Ssu cumpurtamentu hè definitu da una orbitale atomica, una funzione matematica chì caratterizeghja a prubabilità ch'è un elettrone pare truvà si à un postu particulare quandu a so pusizione hè misurata. Solu un inseme discretu (o quantificatu) di 'sse orbitale esiste intornu à u nucleu, chì l'altre forme d'onde pussibile si disintegranu prestu per piglià una forma più stabile. L'orbitale ponu avè una o parechje strutture in anellu o in nodu, è differiscenu l'une da l'altre pè a so taglia, a so forma è u so orientamentu.
Ogni orbitale atomica currisponde à un livellu d'energia particulare di l'elettrone. L'elettrone pò cambià di statu è passà à un livellu d'energia superiore assurbiscendu un fotone chì a so energia hè bastevule per propulsà lu in u nuvellu statu quanticu. Listessa, per emissione spuntania, un elettrone in un statu d'energia superiore pò passà à un statu d'energia inferiore ragendu l'energia eccedentaria sottu forma di fotone. 'Ssi valori d'energia caratteristichi, definite da e differenze d'energia di i stati quantichi, sò rispunsevuli di e linie spettrale atomiche.
A quantità d'energia necessaria per ritirà o aghjunghje un elettrone - l'energia di lega di l'elettroni - hè bella inferiore à l'energia di lega di i nucleoni. Per indettu, ùn ci vole ch'è 13,6 eV per sradicà un elettrone di u statu fundivu di un atomu d'idrogenu, contru à 2,23 milioni d'eV per spaffà un nucleu di deuteriu. L'atomi sò elettricamente neutri s'elli pussedenu un numeru uguale di prutoni è d'elettroni. L'atomi chì anu sia un mancu, sia un soprappiù d'elettroni sò chjamati ioni. L'elettroni chì sò e più alluntanati di u nucleu ponu esse trasfiriti à altri atomi prossimi o spartuti trà l'atomi. Grazia à 'ssu meccanismu, l'atomi sò capace à ligà si in molecule è in altri tipi di cumposti chimichi cum'è i cristalli di reti ionichi è covalenti.
Pruprietà
[mudificà | edità a fonte]Pruprietà nucleare
[mudificà | edità a fonte]Per definizione, dui atomi avendu un numeru identicu di prutoni in u so nucleu appartenenu à listessu elementu chimicu. L'atomi avendu un numeru uguale di prutoni ma un numeru sfarente di neutroni sò isotupi sfarenti di u stessu elementu. Per indettu, tutti l'atomi d'idrogenu ammettenu esattamente un prutone, ma esistenu isotupi senza neutroni (idrogenu-1, da luntanu a forma a più currente, ancu chjamatu proziu), incù un neutrone (deuteriu), incù dui neutroni (triziu) è incù più di dui neutroni. L'elementi cunnisciuti formanu un inseme di numeri atomichi, da l'elementu à un solu prutone, l'idrogenu, à l'elementu à 118 prutoni, l'oganese. Tutti l'isotupi cunnisciuti di l'elementi di numeru atomicu superiore à 82 sò radiuattivi, bench'è a radiuattività di l'elementu 83 (bismutu) sia cusì debule ch'ella hè praticamente trascurevule.
À l'incirca 339 nuclidi sò prisenti à u statu naturale annantu à a Terra, frà i quali 251 (à l'incirca 74%) ùn sò micca stati ossirvati cum'è disintegrendu si, è sò chjamati isotupi stabili. Soli 90 nuclidi sò teuricamente stabili, mentre ch'è 161 altri (purtendu u tutale à 251) ùn sò micca stati ossirvati cum'è disintegrendu si, benchì quessa sia energeticamente pussibile in teuria. Quest'ultimi sò ancu classificati officialmente cum'è stabili. Trenta cinque altri nuclidi radiuattivi anu una mezavita superiore à 100 milioni d'anni è anu una durata di vita abbastanza longa per esse stati prisenti dapoi a nascita di u sistemu sulariu. 'Ssa cullizzione di 286 nuclidi hè cunnisciuta sottu u nome di nuclidi primordiali. Infine, 53 altri nuclidi à corta durata di vita sò cunnisciuti per essei prisenti naturalmente, in quant'è produtti di figliazione di a disgregazione di i nuclidi primordiali (cum'è u radiu di l'uraniu), o in quant'è produtti di prucidimenti energetichi naturali annantu à Terra, cum'è u bumbardamentu da i raghji cosmichi (per indettu, u carboniu 14).
Per 80 di l'elementi chimichi, esiste omancu un isotupu stabile. Di regula, ùn ci hè ch'è una manata d'isotupi stabili per ognunu di 'ssi elementi, a media essendu di 3,1 isotupi stabili per elementu. Vinti sei elementi monoisotopi ùn pussedenu ch'è un solu isotupu stabile, mentre ch'è u più grande numeru d'isotupi stabili ossirvati per un elementu hè di deci, per l'elementu stagnu. L'elementi 43, 61 è tutti l'elementi annumerati 83 o più ùn anu alcunu isotupu stabile.
A stabilità di l'isotupi hè affittata da u rapportu trà prutoni è neutroni, è ancu da a prisenza di certi numeri magichi di neutroni o di prutoni chì riprisentanu cunchiglie quantiche chjuse è empiute. Annantu à i 251 nuclidi stabili cunnisciuti, soli quattru anu à tempu un numeru disparu di prutoni è un numeru disparu di neutroni : l'idrogenu-2 (deuteriu), u litiu-6, u boru-10 è l'azotu-14. (U tantale-180 m hè disparu è stabile siont'è l'ossirvazione, ma omu privede ch'è ellu si disintegra incù una assai longa mezavita). Inoltre, soli quattru nuclidi dispari radiuattivi naturali anu una mezavita superiore à un miliardu d'anni : u potassiu-40, u vanadiu- 50, u lantane-138 è u luteciu-176. A maiò parte di i nuclei dispari sò assai instabili riguardu à a disgregazione beta, chì i produtti di disgregazione sò pari, è sò dunque assai più ligati, per causa di l'effetti d'appaghjamentu nucleare.
A scriscenza radiuattiva
[mudificà | edità a fonte]Ogni elementu pussede unu o parechji isotupi chì e so nuclei instabili sò sughjetti à a disgregazione radiuattiva, ciò chì caghjuneghja l'emissione di particule o d'irraghjamenti elettrumagnetichi da u nucleu. A radiuattività pò produce si quandu u raghju di un nucleu hè grande riguardu à u raghju di a forza forte, chì ùn agisce ch'è annantu à distanze di circa 1 fm. E forme e più currente di disgregazione radiuattiva sò e seguente :
- A disgrigazione alfa : 'ssu prucessu hè pruvucatu da l'emissione da u nucleu di una particula alfa, chì hè un nucleu d'eliu cumpostu da dui prutoni è di dui neutroni. U risultatu di l'emissione hè un nuvellu elementu incù un numeru atomicu inferiore.
- A disgregazione beta (è a cattura d'elettroni) : 'ssi prucidimenti sò retti da a forza debule, è risultanu di a trasfurmazione di un neutrone in prutone, o di un prutone in neutrone. A transizione di u neutrone à u prutone si accumpagna di l'emissione di un elettrone è di un antineutrinu, mentre ch'è a transizione di u prutone à u neutrone (salvu in u casu di a cattura di un elettrone) pruvucheghja l'emissione di un positrone è di un neutrinu. L'emissione d'elettroni o di positroni sò chjamate particule beta. A disgregazione beta aumenta o diminuisce u numeru atomicu di u nucleu di un'unità. A cattura d'elettroni hè più currente ch'è l'emissione di positroni, chì necessiteghja menu energia. In 'ssu tipu di disgregazione, un elettrone hè assurbitu da u nucleu, innanzu ch'è un positrone emessu da u nucleu. Un neutrinu hè sempre emessu in 'ssu prucessu, è un prutone si trasforma in neutrone.
- A disgregazione gamma : 'ssu prucidimentu risulta di un cambiamentu di u livellu d'energia di u nucleu ver'di un statu inferiore, ciò chì caghjuneghja l'emissione di un irraghjamentu elettrumagneticu. U statu azzizzatu di un nucleu chì caghjuneghja un'emissione gamma si produce di solitu dopu à l'emissione di una particula alfa o beta.
Cusì, a disgregazione gamma suvita di solitu a disgrigazione alfa o beta. Altri tipi più rari di disgregazione radiuattiva cumprendenu l'espulsione di neutroni o di prutoni o di matalze di nucleoni di un nucleu, o di più di una particula beta. Un analogu di l'emissione gamma, chì permette à i nuclei azzizzati di perde di l'energia di una manera differenti, hè a cunvirsione interna - un prucessu chì produce elettroni à grande velucità chì ùn sò micca raghji beta, suvitatu da a produzzione di fotoni à alta energia chì ùn sò micca raghji gamma. Uni pochi di grossi nuclei esplodenu in dui o parechji frammenti carchi à massa varievule è parechji neutroni, in una disgregazione chjamata fissione nucleare spuntania. Ogni isotupu radiuattivu hà una periodu di disgregazione caratteristicu - a mezavita - chì hè diterminata da u tempu necessariu affinch'è a mità di un campione si disintegra. Si tratta di un prucessu di disgregazione espunenziale chì diminuisce rigularmente a prupurzione di l'isotupu rimanente di 50 à ogni mezavita. Cusì, à u capu di duie mezavite, ùn ferma più ch'è 25% di l'isotupu, è tira è tocca.
Mumentu magneticu
[mudificà | edità a fonte]E particule elementare pussedenu una pruprietà meccanica quantica intrinseca cunnisciuta sottu u nome di spin. 'Ssa pruprietà hè analoga à u mumentu angulare di un ogettu chì gira intornu à u so centru di massa, benchì omu pensa ch'è 'sse particule sò puntuale è ch'è omu ùn pò micca dì ch'elle voglienu. U spin si misura in unità di a custante di Planck ridutta (ħ), l'elettroni, i prutoni è i neutroni avendu tutti un spin 1/2ħ, o spin- 1/2. In un atomu, l'elettroni in muvimentu intornu à u nucleu pussedenu un attimu angulare orbitale in più di u so spin, mentre ch'è u nucleu ellu stessu pussede un attimu angulare duvutu à u so spin nucleare.
U campu magneticu produttu da un atomu - u so mumentu magneticu - hè diterminatu da 'sse differente forme di mumentu angulare, cum'è un ogettu carcu in rutazione produce classicamente un campu magneticu, ma u cuntributu a più duminante pruvene di u spin di l'elettroni. Datu chì l'elettroni ubbidiscenu à u principu d'esclusione di Pauli, sient'è u quale ùn si pò avè dui elettroni in listessu statu quanticu, l'elettroni ligati si appaghjanu l'uni à l'altri, un membru di ogni paghju essendu in un statu di spin pusitivu è l'l'altru in un statu oppostu, di spin negativu. Cusì, 'ssi spin si annullanu l'unu è l'altru, riducendu l'attimu dipulare magneticu tutale à zeru in certi atomi avendu un numeru paru d'elettroni.
In l'elementi ferromagnetichi tali u ferru, u cobaltu è u nichellu, un numeru disparu d'elettroni inghjenna un elettrone non appaghjatu è à un attimu magneticu glubale nettu. L'orbitale di l'atomi vicini si cavalcanu è un statu d'energia inferiore hè aghjuntu quandu i spin di l'elettroni non appaghjati sò alliniati l'uni incù l'altri, un prucessu spuntaniu cunnisciutu sottu u nome di interazzione di scambiu. Quandu l'attimi magnetichi di l'atomi ferromagnetichi sò alliniati, u materiale pò produce un campu macroscopicu misurabile. I materiali paramagnetichi anu atomi chì i so mumenti magnetichi si allinianu in direzzione aleatorie in l'assenza di campu magneticu, ma l'attimi magnetichi di l'atomi individuali si allinianu in prisenza di un campu.
U nucleu di un atomu ùn averà micca spin quand'ellu pussede un numeru paru di neutroni è di prutoni, ma in l'altri casi di numeri dispari, u nucleu pò avè un spin. Di regula, i nuclei dutati di un spin sò alliniati in direzzione aleatorie per causa di l'equilibriu termicu, ma per certi elementi (cum'è u xenone-129), hè pussibile di pularizà una prupurzione significativa di i stati di spin nucleare affinch'elli sianu alliniati in listessa direzzione - una cundizione chjamata iperpularisazione. 'Ssu finominu hà appiicazione impurtante in imageria per risunanza magnetica.
Livelli d'energia
[mudificà | edità a fonte]L'energia putenziale di un elettrone in un atomu hè negativa quandu a distanza riguardu à u nucleu và insin'à l'infinitu. A so dipindenza rispettu à a pusizione di l'elettrone aghjunghje u minimu à l'internu di u nucleu, à pocu pressu in prupurzione inversa di a distanza. In u mudellu di a meccanica quantica, un elettrone ligatu ùn pò occupà ch'è un inseme di stati cintrati annantu à u nucleu, è ogni statu currisponde à un livellu d'energia specifica. Un livellu d'energia pò esse misuratu da a quantità d'energia necessaria per scioglie l'elettrone di l'atomu, è hè generalmente datu in unità di electronvolt (eV). U statu d'energia u più bassu di un elettrone ligatu hè chjamatu statu fundamentale, vene à dì statu staziunariu, mentre ch'è una transizione di l'elettrone ver'di un livellu superiore dà locu à un statu azzizzatu. L'energia di l'elettrone aumenta incù n chì a distanza (media) à u nucleu aumenta. A dipindenza di l'energia rispettu à ùn hè micca duvuta à u putenziale elettrostaticu di u nucleu, ma à l'interazzione trà l'elettroni.
Affinch'è un elettrone passa da un statu à l'altru, per indettu da u statu fundivu à u prima statu azzizzatu, deve assurbisce o emette un fotone à un'energia currispondendu differentemente à energia putenziale di 'ssi livelli, sient'è u mudellu di Niels Bohr, ciò chì pò esse calculatu precisamente incù l'equazione di Schrödinger. L'elettroni saltanu trà l'orbitale à a manera di una particula. Per indettu, s'è un solu fotone mena l'elettroni, un solu elettrone cambia di statu in risposta à u fotone.
L'energia di un fotone emessu hè propurziunale à a so frequenza, di modu chì 'ssi livelli d'energia specifichi appariscenu cum'è fasce distinte in u spettru elettrumagneticu. Ogni elementu pussede un spettru caratteristicu chì pò dipende di a carica nucleare, di l'interazzione elettrumagnetiche trà l'elettroni è altri fattori.
Quandu un spettru cuntinuu d'energia attraversa un gasu o un plasma, certi fotoni sò assurbiti da l'atomi, ciò chì caghjuneghja un cambiamentu paru d'energia di l'elettroni. L'elettroni azzizzati chì fermanu ligati à u so atomu emettenu spuntaniamente 'ss'energia sottu à a forma di un fotone, culluchendu si in una direzzione aleatoria, è cascanu cusì à livelli d'energia inferiori. Cusì, l'atomi si cumportanu cum'è un filtru chì forma una seria di fasce d'assurbimentu bughje in l'esciuta d'energia. (Un ossirvatore chì vede l'atomi da un puntu di vista chì ùn inchjude micca u spettru cuntinuu in sfondulu, vede piuttostu una seria di linie d'emissione pruvenendu da i fotoni emessi da l'atomi). E misure spettruscopiche di l'intensità è di a larghezza di e strisce spettrale atomiche permettenu di diterminà a cumpusizione è e pruprietà fisiche di una sustanza.
Un'asamina attenta di e linie spettrale svela ch'è certe trà di elle prisentanu un frazziunamentu di a struttura fine. Quessa si produce in raghjone di l'accuppiatura spin-orbita, chì hè un'interazzione trà u spin è u muvimentu di l'elettrone u più esternu. Quandu un atomu si trova in un campu magneticu esternu, e linie spettrale si dividenu in trè compunenti o più, un finominu chjamatu effettu Zeeman. 'Ssu finominu hè duvutu à l'interazzione di u campu magneticu incù l'attimu magneticu di l'atomu è di i so elettroni. Certi atomi ponu avè parechje cunfigurazione elettroniche incù listessu livellu d'energia, chì appariscenu dunque cum'è una sola linia spettrale. L'interazzione di u campu magneticu incù l'atomu culloca 'sse cunfigurazione elettroniche versu livelli d'energia appena sfarenti, ciò chì dà locu à linie spettrale multiplice. A prisenza di un campu elettricu esternu pò pruvucà una divisione è un spustamentu paragunevule di e linie spettrale mudifichendu i livelli d'energia di l'elettroni, un finominu chjamatu effettu Stark. S'è un elettrone ligatu hè in un statu azzizzatu, un fotone interagiscendu incù l'energia apprupriata pò pruvucà l'emissione stimulata di un fotone incù un livellu d'energia currispundente. Affinch'è quessa si produci, l'elettrone deve passà à un statu d'energia inferiore chì a so differenza d'energia currisponde à l'energia di u fotone in interazzione. U fotone emessu è u fotone in interazzione si cullocanu tandu in modu parallelu è incù fase currispundente. In altri termini, e forme d'onda di i dui fotoni sò sincronizate. 'Ssa pruprietà fisica hè usata per fabbricà i laser, chì ponu emette un fasciu cuerente d'energia luminosa in una fascia di frequenza stretta.
Valenza è cumpurtamentu di lega
[mudificà | edità a fonte]A valenza hè u putere di cumbinazione di un elementu. Hè diterminata da u numeru di leghe ch'ellu pò furmà incù altri atomi o gruppi. A cunchiglia elettronica a più esterna di un atomu in u so statu non cumbinatu hè cunnisciuta cum'è a cunchiglia di valenza, è l'elettroni in 'ssa cunchiglia sò chjamati elettroni di valenza. U numeru d'elettroni di valenza ditermineghja u cumpurtamentu di lega incù l'altri atomi. L'atomi anu tindenza à riagisce chimicamente l'uni incù l'altri di modu à empie (o à sbiutà) e so cunchiglie di valenza esterne. Per indettu, u trasfirimentu di un solu elettrone trà atomi hè un'apprussimazione utule per e leghe chì si formanu trà atomi chì a so cunchiglia hè empiuta di un elettrone di più è d'altri chì a so cunchiglia ùn hè micca empiuta di un elettrone, cum'ellu hè u casu in u cumpostu cloruru di sodiu è altri sali chimichi ionichi. Numerosi elementi prisentanu valenze multiplice, o tindenze à sparte un numeru sfarente di elettroni in sfarenti cumposti. Cusì, a lega chimica trà 'ssi elementi piglia numerose forme di spartimentu d'elettroni chì sò più ch'è simplici trasfirimenti d'elettroni. L'elementu carboniu è i cumposti organichi ne sò esempii.
L'elementi chimichi sò à spessu prisintati in un tavulellu periodicu chì hè dispostu di modu à affissà e pruprietà chimiche ricurrente, è l'elementi avendu listessu numeru d'elettroni di valenza formanu un gruppu chì hè alliniatu in listessa culonna di u tavulellu. L'elementi situati à a diritta estrema di u tavulellu anu a so cunchiglia esterna cumplittamente empiuta d'elettroni, ciò chì dà elementi chimicamente inerti cunnisciuti sottu u nome di gasi rari.
Stati
[mudificà | edità a fonte]
Omu trova quantità d'atomi in sfarenti stati di a materia chì dipendenu da e cundizione fisiche, tale a timperatura è a prissione. Fendu varià e cundizione, i materiali ponu passà da un statu solidu à un statu liquidu, gasosu o plasmaticu. In senu à un stessu statu, un materiale pò ancu esiste sottu forma di allotropi sfarenti. U carboniu solidu, chì pò esiste sottu forma di grafitu o di diamante, ne hè un esempiu. Esistenu ancu allotropi gasosi, cum'è u diossigenu è l'ozonu. À timperature prossime di u zeru assolutu, l'atomi ponu furmà un cundensatu di Bose-Einstein. Tandu, l'effetti di a meccanica quantica, chì ùn sò di regula ossirvati ch'è à a scala atomica, diventanu apparenti à a scala macroscopica. Stu inseme d'atomi strarinfriscati si cumporta tandu cum'è un superatomu singulu, ciò chì pò permette verificazione fundive di u cumpurtamentu di a meccanica quantica.
Identificazione
[mudificà | edità a fonte]Quandu l'atomi sò troppu chjuchi per esse visti, dispusitivi tali u microscopiu à effettu tunellu (STM) permettenu di visualizà li à a superficia di i solidi. U microscopiu improda u finominu d'effettu tunellu quanticu, chì permette à e particule di francà un cateru chì seria infranchevule in a pruspittiva classica. L'elettroni si cullocanu per via d'effettu tunellu in u biotu trà dui elettrodi pularizati, furnendu un currente per effettu tunellu chì dipende in modu espunenziale di a so siparazione. Unu di l'elettrodi hè una punta zimbrunuta terminendu si idealmente incù un atomu solu. À ogni puntu di a spazzata di a superficia, l'altezza di a punta hè aghjustata di modu à mantene u currente per effettu tunellu à una valore datu. A quantità di muvimentu di a punta ver'di è dapoi a superficia hè interpritata cum'è u prufilu d'altura. Per una debule polarisazione, u microscopiu visualizeghja a media di l'orbitale elettroniche annantu à livelli d'energia assai vicini - a densità lucale di i stati elettronichi prossimi di u livellu di Fermi. Per causa di distanze implicate, i dui elettrodi devenu esse estremamente stabili ; ùn hè ch'è tandu ch'omu pò ossirvà periudicità currispondendu à atomi individuali. U metudu solu ùn hè micca chimicamente specificu è ùn pò micca identificà e spezie atomiche prisente à a superficia.
L'atomi ponu esse faciule identificati per via di a so massa. S'è un atomu hè iunizatu ritirendu unu di i so elettroni, a so tragettoria quand'ellu attraversa un campu magneticu serà incurvata. U raghju da u quale a tragettoria di un ione in muvimentu hè girata da u campu magneticu hè diterminatu da a massa di l'atomu. U spettrometru di massa improda 'ssu principu per misurà u rapportu massa-carica di l'ioni. S'è un campione cuntene parechji isotupi, u spettrometru di massa pò diterminà a prupurzione di ogni isotupu in u campione misurendu l'intensità di i sfarenti fasci d'ioni. E tecniche di vapurisazione di l'atomi cumprendenu a spettruscopia d'emissione atomica à plasma à accuppiatura induttiva è a spettrumetria di massa à plasma à accuppiatura induttiva, chì usanu tremindui un plasma per vapurizà i campioni da analizà.
U tomografu à sonda atomica hà una risolutezza inferiore à u nanometru in 3D è pò identificà chimicamente atomi individuali imprudendu a spettrumetria di massa à tempu di bulu. E tecniche d'emissione d'elettroni tale a spettruscopia fotoelettronica à raghji X (XPS) è a spettruscopia d'elettroni Auger (AES), chì misuranu l'energie di lega di l'elettroni cintrali, sò usate per identificà e spezie atomiche prisente in un campione di manera non destruttiva. Incù una focalisazione apprupriata, i dui metudi ponu esse specifichi à una zona. Un'antra metudu di 'ssu tipu hè a spettruscopia di perdita d'energia di l'elettroni (EELS), chì misura a perdita d'energia di un fasciu d'elettroni in un microscopiu elettronicu à trasmissione quand'ellu interagisce incù una parte di un campione. I spettri di i stati azzizzati ponu esse imprudati per analizà a cumpusizione atomica di stelle luntane. E lunghezze d'onda specifiche cuntenute in a luce ossirvata di e stelle ponu esse siparate è culligate à e transizione quantificate in l'atomi di gasu liberu.
Note
[mudificà | edità a fonte]- ↑ 'Ss'articulu pruvene in parte da a wikipedia in inglese.
